Geneesmiddelen en beleid
dure geneesmiddelen - perspectieven uit de samenleving
Samenwerking en transparantie in Europa is het devies
Verbeteren van de toegankelijkheid: het kán
Toegankelijke en betaalbare medicijnen en medische hulpmiddelen in Europa en uiteindelijk wereldwijd. Dat is het grote doel van prof. dr. Carin Uyl-de Groot. Ze leidt een Europees project waarin ze met een aantal grote partners rekenmodellen ontwikkelt voor de kosten en impact van het invoeren van nieuwe behandelingen in een land. Hiermee kunnen Europese landen veel meer zelf het heft in handen nemen, in plaats van af te moeten wachten of en wanneer een fabrikant vergoeding aanvraagt. Het raamwerk zal bovendien online beschikbaar en volledig transparant zijn. Dat versterkt de onderhandelingspositie van landen als het gaat om de prijs van de nieuwe middelen.
Lees verder
Uyl-de Groot is hoogleraar Health Technology Assessment en directeur van het institute for Medical Technology Assessment (iMTA) van de Erasmus Universiteit Rotterdam. De toegankelijkheid en betaalbaarheid van (dure) geneesmiddelen is al jaren haar onderwerp. Dat is een complex en relatief "technisch" vraagstuk – en tegelijk letterlijk van levensbelang voor patiënten. Uyl-de Groot beziet dit vraagstuk vooral vanuit een Europese bril. 'Je kunt wel praten over hoe het in Nederland beter kan, maar er zijn ook Europese landen waar patiënten helemaal geen tóegang hebben tot bepaalde geneesmiddelen. En dan hebben we het nog niet eens over de rest van de wereld.'
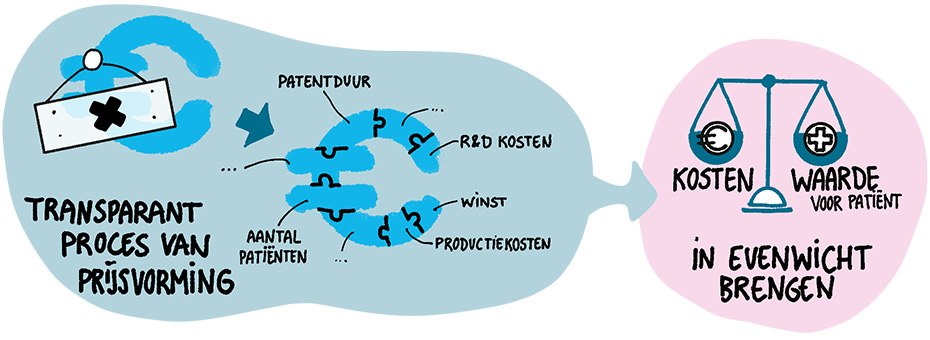
Transparant raamwerk
De Europese call kwam precies op het goede moment. Uyl lanceerde jaren geleden al een alternatief model voor prijsvorming een invloedrijk artikel in het tijdschrift Nature Reviews. Daarin schetste ze de contouren van een transparant proces waarin zowel de kosten (nadrukkelijk inclusief een redelijke winst) en de waarde, dus wat het middel oplevert voor patiënten, met elkaar in evenwicht gebracht worden. De prijsvorming is nu totaal niet transparant. 'We weten dat de prijs die fabrikanten krijgen veel hoger is dan de gemaakte kosten, dat zie je terug in de grote winsten die de industrie maakt. Dat is ook de reden dat ik begonnen met te doordenken hoe we dit kunnen veranderen.'
De markt van innovatieve geneesmiddelen wordt vaak gezien als een vrije markt, maar de vrijemarktprincipes zijn hier helemaal niet van toepassing, stelt Uyl-de Groot. Er is veeleer sprake van een monopolie. 'Als jij een stofzuiger wilt kopen of een auto of wat dan ook, dan ga je je oriënteren: welke merken zijn er, welke eisen stel ik eraan, wat is mijn budget? En dan maak je een keus. Als kankerpatiënt kun je dat niet doen. Je bent afhankelijk van de arts en de arts heeft bepaalde opties om jou te behandelen. Die markt is dus gewoon heel anders, het is beslist geen vrije markt.' De dure geneesmiddelen nemen langzamerhand een zo groot deel van de zorgbudgetten in beslag dat ze andere zorg verdringen. 'De fabrikanten kunnen in feite vragen wat ze willen en daar is nu heel veel discussie over. De prijzen zijn in bepaalde gevallen vertienvoudigd of vertwintigvoudigd, soms in een paar jaar tijd. Ja, natuurlijk is er ook sprake van hogere kosten, maar het is ook zo dat men voelt dat men meer kan gaan vragen.' Daar komt bij dat veel mede ontwikkeld wordt door universiteiten, dus met publiek geld. 'Dat betalen we dan eigenlijk twee keer als belastingbetaler.' Dat kan niet zo doorgaan, maar hoe brengen we kwaliteit, prijs en toegankelijkheid beter in balans?
Hoe gaat het nu?
Eerst even terug naar hoe het nu toegaat: een jarenlang proces en grote verschillen tussen landen. De toelating in een Europees land gaat nu als volgt. De eerste stap is dat het middel geregistreerd wordt bij het EMA, het European Medicines Agency. Daarna mag de fabrikant aan de slag om het middel in een land op de markt te brengen. Ieder land heeft daarvoor zijn eigen toelatingsprocedure. De aanbieder van een nieuw geneesmiddel bepaalt zelf in welke landen hij toelating van het middel vraagt. Logisch dat men dan begint bij grote welvarende landen, waar veel omgezet kan worden. 'Dat is altijd eerst in Duitsland en dan in Engeland en Frankrijk, vaak gevolgd door Italië en Spanje. Welvarende landen en grote markten, waar dus veel verdiend kan worden.' Andere landen komen pas veel later in beeld – of de fabrikanten laten ze zelfs helemaal links liggen omdat er simpelweg te weinig te halen is. Het gevolg is grote ongelijkheid. Als je kijkt naar Europa: patiënten in Oost-Europese landen krijgen óf na drie tot vijf jaar pas toegang tot een bepaald middel of ze krijgen helemaal geen toegang omdat de fabrikant in hun land niet eens de moeite doet om het middel toegelaten te krijgen. 'Dat is geen markt voor ons, krijg ik dan te horen', vertelt Uyl-de Groot, die de verschillen tussen Europese landen in kaart bracht. 'Ja, maar er zijn in die landen wél patiënten die de middelen nodig hebben, denk ik dan.'
Nederland
Een farmaceutisch bedrijf mag zijn geneesmiddel pas op de markt brengen na goedkeuring door een medicijnautoriteit. In Nederland is dat het College ter Beoordeling van Geneesmiddelen (CBG). Het CBG ontvangt van het bedrijf een aanvraag voor registratie en beoordeelt het geneesmiddel op werkzaamheid, veiligheid en kwaliteit. Daarnaast moet er een vergoedingsprocedure in gang gezet worden en die loopt voor (dure) intramurale geneesmiddelen via Zorginstituut Nederland (ZIN). Hiervoor zijn twee dossiers nodig, een farmaco-therapeutisch dossier, dat onder andere de effectiviteit van het middel beschrijft, en een zogeheten farmaco-economisch dossier. In dat laatste gaat het over de kosteneffectiviteit: wat kost behandeling met dit nieuwe geneesmiddel extra ten opzichte van de standaardzorg en wat zijn de additionele opbrengsten? De opbrengst wordt uitgedrukt in QALY’s (Quality-Adjusted Life Years), levensjaren gecorrigeerd voor kwaliteit van leven. De uitkomst noemen we een kosten-effectiviteitsratio. ZIN beoordeelt de rapporten en bepaalt of de nieuwe behandeling doelmatig is. Daarbij geldt 80.000 euro per QALY als drempel voor indicaties met de hoogste ziektelast, dat wil zeggen: een gewonnen levensjaar met goede levenskwaliteit mag 80.000 euro extra kosten. 'Heel vaak zit de kosten-effectiviteitsratio van een nieuw geneesmiddel daarboven en dan moet er dus onderhandeld worden', zegt Uyl-de Groot. De onderhandelingen worden door het prijsbureau van VWS gedaan en zijn geheim. Hier komt al dan niet een overeenkomst tot stand, waarbij de fabrikant in Nederland een korting op de lijstprijs geeft.
En áls dan eenmaal is toegelaten, gaat er vaak nog weer tijd overheen voordat het middel daadwerkelijk wordt toegediend aan patiënten die ervoor in aanmerking komen: ziekenhuizen moeten het inkopen en dokters moeten het voorschrijven. 'Er zit een aardige vertraging in', zegt Uyl-de Groot. 'Van de EMA-registratie tot het aanbieden in één land kan al wel een jaar of soms twee jaar tussen zitten. Daarna komt dan de beoordeling, dat kan ook wel weer een jaar duren. En het kan uiteindelijk ook nog zo zijn dat het middel niet wordt toegelaten omdat het te duur is voor wat het oplevert, zoals recent gebeurde met een middel tegen borstkanker.'
Los van het formele beoordelingstraject hebben we in Nederland ook nog de commissie BOM (Beoordeling Oncologische Middelen), waar Uyl-de Groot lid van is. In die commissie geeft de beroepsgroep haar professionele medisch-inhoudelijke beoordeling van de meerwaarde van een nieuw oncologisch middel. Het Zorginstituut maar ook zorgverzekeraars hechten hier grote waarde aan en de commissie BOM legt zodoende veel gewicht in de schaal bij de toelating. Het is een parallelle beoordeling, dus dit kost in principe geen extra tijd. Dan nog gaat het ook in Nederland al met al om een proces dat jaren kan duren, jaren waarin patiënten verstoken blijven van een middel waar ze baat bij hebben. Het zijn óók jaren waarin de fabrikant in Nederland geen omzet heeft en dus geen winst maakt met dit middel. Dus, stelt Uyl-de Groot, ook de farmaceuten hebben belang bij een sneller proces en zouden dat kunnen bevorderen door een redelijke prijs te vragen, zodat tijdrovende prijsonderhandelingen overgeslagen kunnen worden.
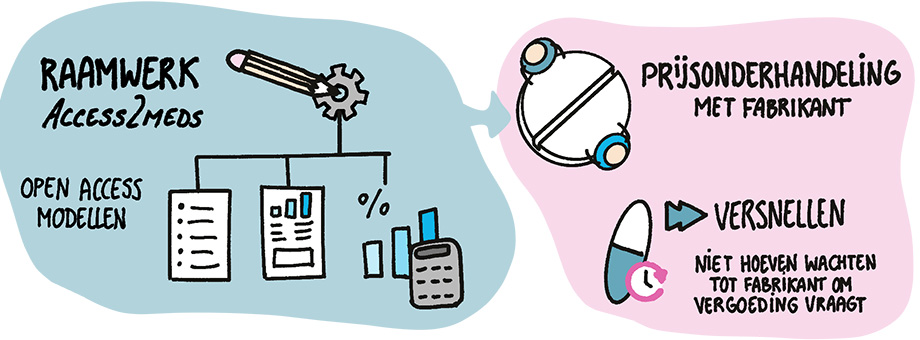
Acces2meds
De Europese call kwam dus als geroepen. Het ASCERTAIN-project werd gehonoreerd en ging vorig najaar van start. Het geeft Uyl-de Groot de kans om – met een scala aan grote Europese partners – haar ideeën in de praktijk te brengen. 'Met het Europese project wil ik dingen gaan versnellen. We moeten toe naar Europese regelgeving, zodat iedereen hetzelfde gaat doen. Wat is een goede basis, hoe bepaal je wat een redelijke prijs is voor een kankerbehandeling? We zoeken daarin een combinatie van value based, dus wat levert het middel op voor patiënten, en cost based: wat zijn de ontwikkel- en productiekosten.' Ook een redelijke winstmarge maakt deel uit van het raamwerk en er wordt gekeken of er genoeg return on investment is voor de investeerders. Het doel van het project is, naast verbetering van de toegang, ook het stimuleren van innovatie. 'We gaan open access modellen maken die landen zelf kunnen invullen zodat ze dit kunnen gebruiken bij de onderhandeling met de fabrikant. Deze modellen zijn gericht op prijs, kosteneffectitviteit, impact op het budget en vergoeding van nieuwe kankerbehandelingen.' De bedoeling is dat een land niet hoeft te wachten tot een fabrikant vergoeding vraagt voor een middelen en daartoe een dossier gaat indienen. Nee, veel informatie komt gewoon al online en is direct toegankelijk voor beleidsmakers. 'We hebben het raamwerk Acces2meds gedoopt. Het gaat uitdrukkelijk ook over de bijbehorende hulpmiddelen, want je kan wel immunotherapie hebben maar als je niet beschikt over de apparatuur voor whole genome sequencing dan heb je daar niks aan.'
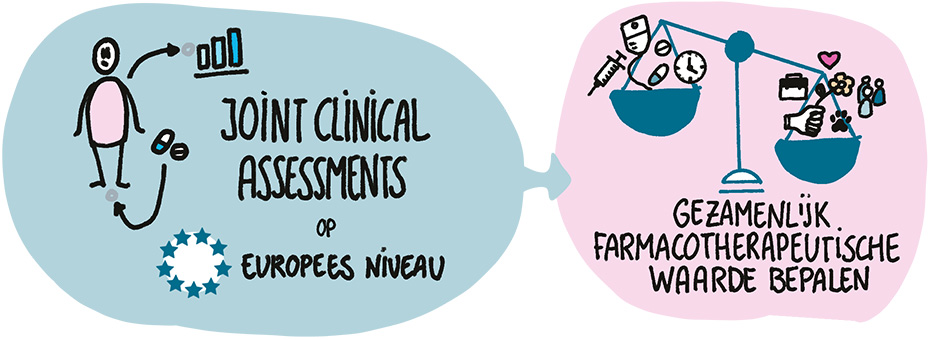
De verschillende Europes landen blijven vooralsnog wel ieder voor zich onderhandelen met de fabrikanten. Een eerste stap om tot meer eenheid te komen in Europa, waar nu aan gewerkt wordt, is het uitvoeren van zogenaamde joint clinical assessments. Samen, op Europees niveau, de farmacotherapeutische waarde bepalen dus. Dit wordt verplicht voor bepaalde (kanker)geneesmiddelen vanaf 2025. Als het Europa lukt om ook meer één lijn te trekken met betrekking tot toelating en vergoeding, gaat dat ten koste van de onderhandelingspositie van de farmaceutische industrie. Aan de andere kant kunnen de fabrikanten hier ook bij winnen: 'Een jaar eerder toegang in een land betekent een jaar eerder patiënten behandelen en dus meer omzet.'
Samenwerken met de industrie
Uyl-de Groot is weliswaar kritisch over de farmaceutische industrie, maar zoekt daarin ook de nuance. Ze vindt het belangrijk om de fabrikanten te betrekken bij ontwikkelen van Acces2meds. 'Innovatie mag ook beloond worden. Het moet voor de fabrikanten en voor hun investeerders ook interessant zijn, daar moet een balans in gevonden worden.' De industrie krijgt vaak de zwarte piet toegespeeld en dat vindt ze niet helemaal terecht. 'Fabrikanten doen inderdaad soms dingen die niet netjes zijn, maar op zich heb ik er helemaal geen problemen mee dat ze winst maken. Zolang een patiënt het middel krijgt dat hij nodig heeft, is dat prima. Innovatie mag beloond worden en er mag winst gemaakt worden.'
En een punt dat specifiek voor ons land geldt, is dat Nederland relatief weinig uitgeeft aan geneesmiddelen – zo’n 6 procent van het totale zorgbudget, tegen de veel grotere portie van 10, 11 of soms 12 procent van het budget die andere Europese landen aftikken. 'En de prijsstijging is bij ons ook aanzienlijk minder steil. Dus ja, geneesmiddelen zijn duur, maar bij ons valt het eigenlijk nog mee.' Dit is vooral het resultaat van de sterke bezuiniging op de generieke middelen. De farmaceutische industrie verdient in Nederland daardoor minder dan elders. Scherp onderhandelen over de dure geneesmiddelen, prima, maar: 'We moeten ons ook niet uit de markt prijzen als land.'
Uyl-de Groot wil hier ook mee zeggen: laten we dure geneesmiddelen niet alleen benaderen als een kostenpost die we zo klein mogelijk moeten houden. 'Stel, de prognose voor Nederland is dat er aan een bepaald nieuw middel 200 tot 400 miljoen zal worden uitgegeven. En de daadwerkelijke uitgaven komen op 80 miljoen – alle bedragen gerekend zonder eventuele kortingen, dus daar zit het verschil niet in. Dan kun je zeggen: mooi dat we aan dit middel veel minder hebben uitgegeven dan voorspeld. Maar dat cijfer vertelt ons ook dat een heleboel patiënten die er wel voor in aanmerking kwamen, het middel niet gehad hebben! Dus zo mooi vind ik dat niet.'
Wat is een maatschappelijk aanvaardbare prijs
Als het gaat om geneesmiddelen en de financiering daarvan dringt al snel de vraag op wat maatschappelijk aanvaardbaar of verantwoord is. Deze vraag werd voorgelegd aan de Autoriteit Consument en Markt en de Vereniging van Innovatieve Geneesmiddelen. In onderstaande uitklapmenu's zijn hun bijdragen opgenomen.
Stel de prikkels centraal bij het vaststellen van een maatschappelijk aanvaardbare prijs
Auteurs: Ilan Akker en Milena Dinkova, beide senior medewerker toezicht bij Autoriteit Consument en Markt. De bijdrage is op persoonlijke titel.
Traditioneel bepaalt de samenleving wat ze bereid is te betalen voor een nieuw geneesmiddel op basis van de gezondheidswinst ten opzichte van bestaande therapieën. Dit wordt gemeten in QALY's (quality-adjusted life years), waarin zowel extra levensjaren als levenskwaliteit worden gewaardeerd. In Nederland hebben we vuistregels van €20.000, €50.000 en €80.000 per QALY, afhankelijk van de ziektelast. Deze waarden vertegenwoordigen onze maximale willingness to pay (WTP) voor één extra QALY. Deze benadering werkt goed als prijzen losstaan van wat we bereid zijn te betalen, maar dat is zelden het geval. Farmaceutische bedrijven bepalen vaak de prijs van een geneesmiddel op basis van wat de samenleving ervoor over heeft, wat leidt tot te hoge kosten voor de maatschappij. Daarom betrekt de Adviescommissie Pakketbeheer (ACP) steeds vaker andere factoren dan alleen de waarde van het geneesmiddel in hun advies.
Een alternatief voor het waardegedreven model is het kostengedreven model, waarbij fabrikanten een prijs mogen vragen die hun kosten, inclusief een redelijke winstmarge, dekt. Het nadeel hiervan is echter dat de link met de toegevoegde waarde voor patiënten ontbreekt. We willen niet betalen voor matig werkende medicijnen omdat er veel geld in is gestoken. Aan de andere kant willen we in bepaalde situaties wel een hoge prijs betalen voor een significant effectiever middel, ongeacht de lage kosten voor de fabrikant.
Ons pleidooi bij het bepalen van een maatschappelijk aanvaardbare prijs? Stel de prikkels voor fabrikanten om waardevolle medicijnen te ontwikkelen tegen een redelijke prijs voor patiënten centraal. Dit is een verfijning van de waardegedreven benadering en vereist het meenemen van meer factoren. We geven twee voorbeelden:
Volume
Het aantal patiënten (volume): Bij hogere volumes onderhandelt het inkoopbureau van VWS 1 harder en maakt staffelafspraken. Omdat geneesmiddelen eerder open in het systeem stroomden (er was geen sluis), konden dergelijke afspraken nauwelijks gemaakt worden. Het gebruik van het middel bij een hoger dan verwacht aantal patiënten zou echter iets moeten betekenen voor de prijs. Als we – om het voorbeeld eenvoudig te houden - productie- en marketingkosten wegdenken, zou dat bij verdubbeling van het aantal patiënten betekenen dat de overheid de vergoedingsprijs halveert. Je wilt echter wel de prikkel inbouwen voor fabrikanten om medicijnen te ontwikkelen voor een grotere patiëntgroep, wat een hoger rendement rechtvaardigt bij hogere volumes.
Innovatie
De mate van innovatie: Gaat het om een nieuw middel met grote gezondheidswinst? Of om de registratie van een bestaande toepassing van een ouder middel? Of, als tussencategorie, een echte drug recovery? Alleen bij medicijnen met aanzienlijk grotere gezondheidswinst moet de maatschappij een premiumwaarde betalen. Voor geneesmiddelen met bewezen veiligheid en weinig innovatie zou de prijs laag moeten zijn.
Naast deze factoren moeten ook kosten, ontwikkelingsrisico's en de mate van zekerheid dat een medicijn effectief zal zijn worden meegenomen. In de praktijk zul je daarmee verschillende methodes moeten combineren om tot een maatschappelijk aanvaardbare prijs te komen. Daarbij is het van belang voor ogen te hebben hoe we perverse prikkels, zoals evergreening (het ontwikkelen en registreren voor een marginale verbetering), uit het systeem kunnen krijgen. Het ultieme doel is om de prikkels voor fabrikanten in lijn te brengen met de maatschappelijke waarde. De rechtvaardiging voor een prijs zit dan ook in de prikkel die we als samenleving willen geven om dergelijke middelen te ontwikkelen.
1 Het Buro Financiële Arrangementen Geneesmiddelen (BFAG).
Geneesmiddelen hebben een maatschappelijke verantwoorde prijs (VIG)
Auteur: Vereniging Innovatieve Geneesmiddelen
De betrokkenheid is groot als het gaat om medicijnen. Neem het groeiende maatschappelijk debat over prijsstelling, beschikbaarheid en toegankelijkheid. Een belangrijke en zinvolle discussie, ook voor ons als VIG: er zijn effectieve medicijnen, meer gebruikers, en ja, in dat kader telt elke euro. Betaalbaarheid is een cruciaal aspect van een goed functionerend zorgsysteem. Want kunnen rekenen óp geneesmiddelen, is moeten rekenen mét kosten. De vraag is wel: hoe doen we dat samen, waar lopen we tegenaan?
Waar hebben we als VIG het over?
- De geneesmiddelenbedrijven zijn in eerste instantie ontwikkelaars van nieuwe innovatieve behandelingen. Dat vergt een enorme investering en grote risico’s. Het kost tussen € 2,6 en € 3,4 miljard euro om, binnen een periode van 10 tot 12 jaar, een geneesmiddel te ontwikkelen
- De uitgaven aan specialistische geneesmiddelen per patiënt is sinds 2014 sterk gedaald en de afgelopen jaren constant. Extramurale geneesmiddelen kennen zelfs een forse daling sinds 2013
- De uitgaven aan geneesmiddelen zijn al jaren een gelijk deel van de zorguitgaven
Een greep uit de dilemma’s
Geneesmiddelen in Nederland hebben allemaal een maatschappelijk verantwoorde prijs. Deze zijn vaak niet zichtbaar door onderhandelingen en geheime prijskortingen. Bijvoorbeeld in de zogenoemde geneesmiddelensluis waar in 2020 al bijna 750 miljoen euro aan korting via zorgverzekeraars terug vloeit in de zorg.
Het Nederlandse systeem bestaat uit prijsregulering en bevorderen van concurrentie. Zoals maximumprijzen, onderhandelingen door de Minister en zorgverzekeraars, pakketvereisten door het Zorginstituut en grote concurrentie van generieken en biosimilars.
Alle geneesmiddelen komen niet automatisch beschikbaar voor patiënt, maar worden eerst beoordeeld op kosteneffectiviteit. Geneesmiddelen vormen hierin een uitzondering. Meer dan de helft van de ziekenhuiszorg is echter niet bewezen effectief, is de conclusie uit een eerder rapport van ZEGG. Laten we daarom alle zorg tegen dezelfde meetlat leggen en toetsen op kosteneffectiviteit.
Betaalbaarheid van geneesmiddelen ligt niet aan de prijs maar aan de enorm sterk groeiende vraag naar geneesmiddelen door behandelaren en patiënten. Gecombineerd met de afspraken in het Integraal Zorgakkoord waarbij ziekenhuizen niet worden gecompenseerd voor deze enorme uitgaven groei.
Hoe nemen wij als VIG al maatschappelijke verantwoordelijkheid?
- Wij zetten ons in om de ontwikkeling van nieuwe geneesmiddelen te versnellen en efficiënter te maken. Dat leidt uiteindelijk tot verlaging van ontwikkelkosten.
- Wij zetten ons in om gepast gebruik te stimuleren via bijvoorbeeld moleculaire diagnostiek, farmacogenetica en patiëntprofielen.
- We monitoren hoe we geneesmiddelenzorg kunnen voorkomen en hoe arbeid in de zorg te besparen, via RWD en RWE. De maatschappelijk aanvaardbare waarde van een middel hangt tenslotte niet alleen af van de prijs.
- Wij investeren in de verduurzaming van ontwikkeling, productie, distributie en gebruik van onze geneesmiddelen
- We hebben ons onafhankelijk Adviescollege van de Code (destijds met leden André Rouvoet, Koos van der Hoeven en Cathy van Beek) gevraagd om advies voor een verantwoorde prijsstelling. Hun advies is opgenomen in onze Code.
Inzet van geneesmiddelen verbeteren met real world data: drie voorbeelden
Het delen van real world data kan helpen om de doelmatige inzet van geneesmiddelen te verbeteren. Doranne Hilarius is ziekenhuisapotheker in het Rode Kruis Ziekenhuis en voorzitter van de Clinical Audit Board van de kwaliteitsregistratie DICA Geneesmiddelen. Ze geeft drie voorbeelden uit de praktijk.
De geneesmiddelenmonitor wordt door 48 ziekenhuizen gebruikt. Op basis van bestaande databronnen worden specifieke vragen rondom geneesmiddelen beantwoord. Bijvoorbeeld hoe middelen worden gebruikt en wat de uitkomsten zijn. Sprekende voorbeelden zijn:
Lees verder
Naleven van richtlijnen
De richtlijn bij stadium III darmkanker schrijft voor dat adjuvante chemotherapie bij voorkeur 4 tot 8 weken na de operatie wordt gestart. Wordt er conform die richtlijnen gehandeld, en verschilt dat tussen verschillende ziekenhuizen (de zogeheten praktijkvariatie)? Uit de analyse van de monitor blijkt dat alle ziekenhuizen de richtlijn naleven en zich aan de termijn van 8 weken houden en één ziekenhuis iets eerder de therapie start dan de voorgeschreven 4 weken. Het verschil tussen het ziekenhuis met de laagste en hoogste mediaan is drie weken.
Hybride doseringen
De NVALT heeft in haar richtlijn de voorkeur uitgesproken om bij immunotherapie hybride dosering toe te passen. Het hybride dosering heeft een grote impact op de kosten. In spiegelbijeenkomsten werden mogelijkheden voor hybride doseringen voor de behandeling van niet-kleincellig longcarcinoom met Pembrolizumab besproken met apothekers en medisch specialisten. Is een lagere dosering medisch verantwoord? Welke juridische, organisatorische en technische uitdagingen zijn er?
Uiteindelijk konden resultaten bekeken worden van 15 ziekenhuizen die hybride doseringen toepasten. Op basis daarvan werd een besparingspotentieel waargenomen van 23 procent voor een klein Nederlands ziekenhuis, en 24 procent bij een groot ziekenhuis. Het onder de aandacht brengen en monitoren van de effecten van hybride doseren middels de monitor en spiegelsessies van de kwaliteitsregistratie Dure Geneesmiddelen draagt bij aan de implementatie.
Behandeling in de laatste levensfase
Hoe vaak worden patiënten met nieuwe geneesmiddelen behandeld in de laatste levensfase? Op basis van een koppeling met Vektis zag de monitor een grote praktijkvariatie van 19 tot 47 procent. In het ene ziekenhuis werd dus bij één op de vijf patiënten nog een nieuwe behandeling gestart in de drie maanden voor het overlijden, en in het andere ziekenhuis was dat bijna de helft. Het is waardevol deze inzichten te delen en de discussie over het hoe en waarom met elkaar te delen, op zoek naar de meest patiëntgerichte en doelmatige zorg.
De uitkomsten van deze analyses worden besproken met de betrokken ziekenhuizen, waarmee ze van elkaar kunnen leren en zo de patiëntzorg kunnen verbeteren, meer patiëntgericht en doelmatiger kunnen behandelen en/of kosten reduceren.
Sneller inzicht in effectiviteit met R(H)ONDA
Voor de zich snel ontwikkelende praktijk van de Hematologie en Oncologie is actualisatie van data een must. Dat wil zeggen: data verzamelen, analyseren en publiceren die vroeg in het behandeltraject beschikbaar komen (real world data). Dan zijn behandelaars en patiënten op wetenschappelijke wijze eerder op de hoogte van de veiligheid en effectiviteit van nieuwe, dure geneesmiddelen en behandelstrategieën. Met het project R(H)ONDA is IKNL bezig om deze actualisatie te realiseren. Begonnen in de Hemato-Oncologie (vandaar de H) breidt het project zich nu uit naar diverse diagnosegroepen met solide kankers zoals dikke darmkanker. In R(H)ONDA werken Performation, met de door hen ontwikkelde datagateway, en IKNL nauw samen, zodat data uit EPD’s automatisch en onder supervisie van de datamanagers, worden ingelezen in de NKR. Zo zijn we snelheid en volume aan het realiseren. Gestart in vijf pilot ziekenhuizen breiden we deze infrastructuur uit naar de rest van de Nederlandse ziekenhuizen en radiotherapeutische instituten.