IKNL | oktober 2024
Kanker van het hoofd-halsgebied in Nederland
NASOFARYNXKANKER
Meer tumorspecifieke cijfers: mondholtekanker | orofarynxkanker | nasofarynxkanker | hypofarynxkanker | larynxkanker | neus(bijholte)kanker | lymfekliermetastasen | speekselklierkanker
a. voorkomen nasofarynxkanker
Nasofarynxkanker wordt ongeveer 70 keer per jaar vastgesteld, vaker bij mannen dan bij vrouwen; 50 keer versus 20-25 keer per jaar. De gestandaardiseerde incidentie nam significant af met 0,8% per jaar. Bij mannen nam de gestandaardiseerde incidentie significant af met 1,2% per jaar. Bij vrouwen nam de gestandaardiseerde incidentie niet statistisch significant af met 0,3% per jaar.
nieuwe diagoses naar leeftijdsgroep
36% procent van de mensen met nasofarynxkanker is 45-59 jaar oud bij diagnose, gevolgd door 33% in de leeftijdscategorie 60-74 jaar.
b. weefseltypering
Het grootste deel van de nasofarynxkanker, namelijk 60%, is plaveiselcelcarcinoom (WHO type I + WHO type II + PCC, niet nader omschreven) en 28% ongedifferentieerd carcinoom. Idealiter rapporteren we alle nasofarynxkanker ingedeeld naar WHO-type, maar helaas hebben we niet altijd de juiste informatie tot onze beschikking om het type te onderscheiden.
Sinds 2017 leggen we de EBV-status vast, maar deze is (m.n. in de beginperiode) vaak onbekend. Vanaf 2021 is het aandeel onbekend 13% en was 66% van de nasofarynxkanker EBV-gerelateerd.
c. klinisch stadium
45% van de nasofarynxkanker wordt gediagnosticeerd in stadium IV, gevolgd door 26% in stadium III. Dat terwijl er bij beperkte ziekte (zoals wij dat hier classificeren) ook uitzaaiingen in regionale lymfeklieren kunnen voorkomen omdat T1-2 tumoren met een N1-classificatie onder stadium II vallen.
d. uitgebreidheid ziekte
Uitgebreide ziekte komt het vaakst voor (61%). 10% van de mensen met nasofarynxkanker hebben afstandsmetastasen bij diagnose.
e. behandeling naar uitgebreidheid ziekte
Beperkte ziekte wordt in 51% van de gevallen met alleen radiotherapie en 39% met radiotherapie en met systemische therapie behandeld. Uitgebreide ziekte wordt in 72% van de gevallen met radiotherapie en systemische therapie behandeld. Patiënten met op afstand uitgezaaide ziekte worden ongeveer even vaak met alleen radiotherapie (28%), niet-tumorgericht (24%), met radiotherapie en systemische therapie (22%) of met alleen systemische therapie (20%) behandeld.
Radiotherapie bij nasofarynxkanker
Auteur: Anne van den Hoek, radiotherapeut-oncoloog UMCG
De prognose en kwaliteit van leven van patiënten met nasofarynxkanker verbeterde de laatste jaren sterk door veranderingen in chemotherapie en technische verbeteringen in de radiotherapie. Zowel de diagnostiek als de behandeling van patiënten met nasofarynxkanker zijn erg complex en intensief en kunnen leiden tot een breed spectrum van acute en late bijwerkingen. De primaire behandeling van nasofarynxkanker is radiotherapie, vaak in combinatie met chemotherapie. Bij een behandeling met radiotherapie bestraald de radiotherapeut de tumor en de eventuele uitzaaiingen in de hals met een hoge dosis. Lymfekliergebieden in de hals waar nog geen tumorcellen zijn gevonden worden altijd uit voorzorg bestraald met een lagere dosis (electieve bestraling). Soms krijgen patiënten voorafgaand aan de bestraling chemotherapie om de tumor te verkleinen. Chemotherapie kan ook tijdens de bestraling gegeven worden om de tumorcellen gevoeliger te maken voor de radiotherapie1.
Radiotherapie bij patiënten met nasofarynxcarcinoom kan leiden tot bijwerkingen in zowel de acute (tot 3 maanden na behandeling) als in de late fase (> 3 maanden na behandeling). Veel patiënten ontwikkelen een droge mond (xerostomie) en slikklachten (dysfagie), maar hebben ook een grote kans op smaakproblemen, tandbederf, pijn en hebben vaker geheugen- en concentratieproblemen in de jaren na radiotherapie. Cisplatin, het meest gegeven chemotherapiemiddel, kan ook flinke bijwerkingen veroorzaken: vermoeidheid, misselijkheid en braken, gehoorverlies, nierfunctieverlies en schade aan het zenuwstelsel (neuropathie). Nierfunctieverlies, gehoorverlies en neuropathie kunnen permanent zijn.
Vooral late bijwerkingen hebben een belangrijke impact op het dagelijks functioneren en de kwaliteit van leven van mensen die nasofarynxkanker hebben (gehad). Preventie van late effecten van de behandeling is daarom van groot belang, zeker gezien de uitstekende prognose van patiënten met nasofarynxkanker. De introductie van protonentherapie biedt hierin kansen. Tot 2018 werden alle patiënten met nasofarynxkanker behandeld met fotonentherapie. Bij protonentherapie kan de stralingsdosis in gezonde weefsels aanzienlijk worden verminderd waardoor er minder acute en late bijwerkingen kunnen zijn ten opzichte van een behandeling met fotonentherapie. De eerste resultaten bij patiënten met nasofarynxkanker die met protonentherapie zijn behandeld, laten een afname zien van ongeveer 50% van de patiëntgerapporteerde klachten tijdens en vlak na de behandeling in vergelijking met radiotherapie met fotonen.
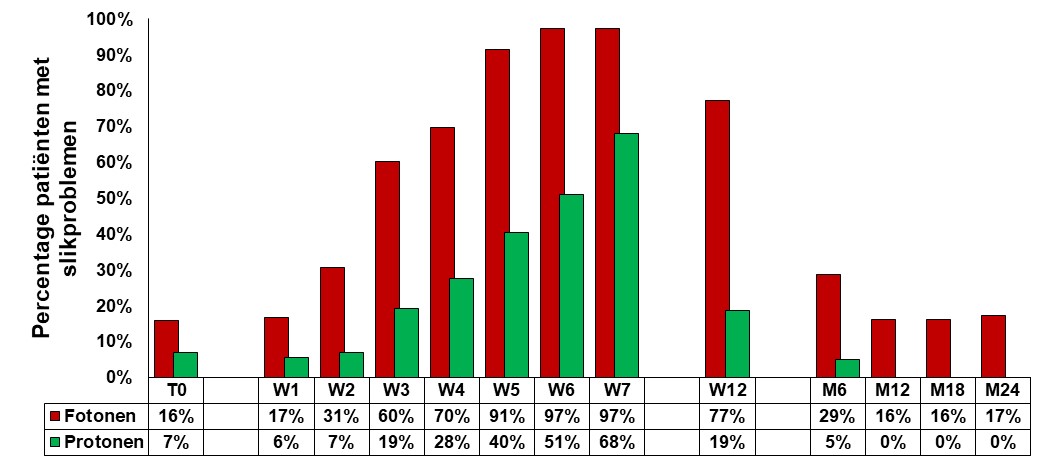
Verschil in slikproblemen (d.w.z. niet in staat tot het eten van vast voedsel en/of afhankelijk van sondevoeding) tussen patiënten die zijn bestraald met fotonen (rood) t.o.v. patiënten die zijn bestraald met protonen (groen). T0 is voor start behandeling. W1 t/m W7 is 1ste t/m 7de week tijdens behandeling. W12 is 5 weken na einde behandeling. M6 t/m M24 is 6 maanden t/m 24 maanden na einde bestraling. Patiënten die met protonen zijn behandeld hebben minder slikproblemen tijdens radiotherapie en herstellen ook sneller na het einde van de radiotherapie (W12). Op de langere termijn (d.w.z. na 6 maanden) waren er na protonentherapie geen patiënten meer met slikproblemen, terwijl bij de met fotonentherapie behandelde patiënten in 16-29% van de gevallen slikproblemen bleven bestaan.
Voor de selectie van patiënten voor protonentherapie moet een planningsvergelijking verricht worden. Het fotonenplan van de desbetreffende patiënt wordt vergeleken met het protonenplan. Aan de hand van zogenaamde normal tissue complication probability (NTCP)-modellen kan dan een schatting worden gemaakt van het verschil in de kans op bijwerkingen na een protonen- en fotonenbehandeling. Als dit verschil groot genoeg is, conform de criteria van het Landelijk Indicatie Protocol Protonen van Hoofd Hals tumoren, kan een patiënt worden behandeld met protonentherapie.
Bijwerkingen kunnen ook afnemen door het verkleinen van de electieve bestralingsgebieden in de hals en rondom de primaire tumor2. Dit kan zowel bij fotonen- als bij protonentherapie. De protonentherapie zelf ontwikkelt zich ook: Proton Arc Therapy is een nieuwe protonentechniek in ontwikkeling die de gezonde weefsels nog meer spaart. Hierdoor nemen naar verwachting de late bijwerkingen voor patiënten nog verder af3.
Vanwege de zeldzaamheid van de tumor en de complexiteit van de behandeling van nasofarynxkanker kan de behandeling van deze patiënten het beste plaatsvinden in een expertisecentrum voor nasofarynxkanker.
Referenties
Bossi et al. Nasopharyngeal carcinoma: ESMO-EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of oncology 2021;32:452-465
Tang et al. Elective upper-neck versus whole-neck irradiation of the uninvolved neck in patients with nasopharyngeal carcinoma: an open-label, non-inferiority, multicentre, randomised phase 3 trial. Lancet Oncol 2022;23:479-90
de Jong BA, Battinelli C, Free J, Wagenaar D, Engwall E, Janssens G, Langendijk JA, Korevaar EW, Both S. Spot scanning proton arc therapy reduces toxicity in oropharyngeal cancer patients. Med Phys. 2023 Mar;50(3):1305-1317. doi: 10.1002/mp.16098. Epub 2023 Jan 17. PMID: 36373893.
f. doorlooptijd
De mediane tijd tussen het eerste consult en start van de behandeling voor curatief behandelde patiënten verbeterde gestaag van een mediane doorlooptijd boven de 30 dagen tot en met 2018 naar een mediane doorlooptijd van 20 dagen in 2023.
g. relatieve overleving
De relatieve 5-jaarsoverleving voor nasofarynxkanker verbeterde van 43% begin jaren negentig naar 63% in 2013-2018.
Meer tumorspecifieke cijfers:
mondholtekanker | orofarynxkanker | nasofarynxkanker | hypofarynxkanker | larynxkanker | neus(bijholte)kanker | lymfekliermetastasen | speekselklierkanker
Bent u op zoek naar meer of andere cijfers over een bepaalde tumorsoort? IKNL maakt overzichten op basis van de gegevens in de Nederlandse kankerregistratie en publiceert over onderwerpen zoals incidentie, overleving en prevalentie. Met NKR cijfers kunt u zelf cijfers samenstellen over incidentie, prevalentie, sterfte en overleving naar geslacht, leeftijd en provincie. Ook is het mogelijk om cijfers op maat aan te vragen.
*Definities
Tumorclassificatie volgens ICD-O-3 (Fritz et al., 2000)
- Mondholte C00.3-C00.5, C02-C06 m.u.v. van C05.1 en C05.2
- Orofarynx C01, C05.1, C05.2, C09-C10 m.u.v. C10.1
- Nasofarynx C11
- Hypofarynx C12-C13
- Larynx C32, C10.1
- Neus(bij)holte C30.0, C31
- Grote speekselklieren C07-C08
Morfologiecodes volgens ICD-O-3 (Fritz et al., 2000)
Basis (specificatie gaat voor op basis):
- Neoplasma, NOS 8000-8009, 9990
- Epitheliaal carcinoom, NOS 8010-8049
- Neuroendocrien carcinoom 8013, 8041-8045, 8240-8249
- Plaveiselcelcarcinoom 8050-8089
- Adenocarcinoom 8140-8389
Additioneel aangepast voor (gaat voor op basis):
Mondholte
- Passend bij speekselkliercarcinoom 8140-8389, 8410, 8430, 8440-8499, 8500-8502,8525,8550,8551,8562,8940,8941,8980,8022,8982
Nasofarynx
- Basaloïd carcinoom 8083
- WHO type I, plaveiselcelcarcinoom, keratiniserend 8071
- WHO type II, plaveiselcelcarcinoom, niet-keratiniserend 8072,8073,8085 in combinatie met differentiatiegraad 1,2 of 9
- WHO type III, ongedifferentieerd carcinoom, niet-keratiniserend 8072,8073,8085 in combinatie met differentiatiegraad 3 of 4 of 8020,8021, 8082
Neus(bij)holte
- Adenoïd cysteus carcinoom 8200,8201
- Intestinaal type adenocarcinoom 8144
- Sinonasaal ongedifferentieerd carcinoom 8020
Grote speekselklieren
- Passend bij speekselkliercarcinoom 8140-8389, 8410, 8430, 8440-8499, 8500-8502,8525,8550,8551,8562,8940,8941,8980,8022,8982
- Adenoïd cysteus carcinoom 8200,8201
- Acinic cell carcinoom 8550,8551
- Mucoepidermoïd carcinoom 8430
- Carcinoma ex pleomorphic adenoma 8940,8941,8022
- Myo-epitheliaal carcinoom 8562,8982
- Salivary duct carcinoom 8500
- Secretoir ca (MASC) 8502
- Polymorphous adenoca 8525
- Basaalcel adenoca 8147
Klinisch stadium volgens TNM8 (International Union Against, 2017)
*Classificatie uitgebreidheid ziekte
- beperkte ziekte (stadium 0, I of II)
- uitgebreide ziekte (stadium III, IVM0)
- ziekte op afstand (M1)
Behandeling
Categorieën die we onderscheiden in deze publicatie
0 = Geen tumorgerichte therapie
1 = Alleen chirurgie
2 = Chirurgie en radiotherapie
3 = Chirurgie en systemische therapie
4 = Chirurgie en radiotherapie en systemische therapie
5 = Alleen radiotherapie
6 = Radiotherapie en systemische therapie
7 = Alleen systemische therapie
8 = Overig
9 = Onbekend
Excisiebiopt gevolgd door therapeutisch behandeling (radiotherapie/resectie) wordt als radiotherapie/resectie meegenomen in de classificatie
Wanneer uitsluitend HKD als chirurgische ingreep is gecodeerd, wordt dit voor CUP als chirurgie meegenomen
Doorlooptijd start behandeling
Aantal dagen tussen de eerste afspraak in het behandelend ziekenhuis en de dat van eerste behandeling, te weten chirurgie, radiotherapie danwel systeemtherapie o.b.v. DHNA data: landelijk dekkend vanaf 2019; 2023 betreft een half registratiejaar. Binnen de DHNA omvat neus(bij)holtekanker ook kanker van het middenoor.
Relatieve overleving
De relatieve 5-jaarsoverleving beschrijft het percentage patiënten met een ziekte dat in leven is, vijf jaar nadat de ziekte is gediagnosticeerd, gedeeld door het verwachte percentage mensen dat in leven is op basis van levensverwachting in de algemene bevolking met dezelfde leeftijd en geslacht.
De relatieve 10-jaarsoverleving beschrijft het percentage patiënten met een ziekte dat in leven is, tien jaar nadat de ziekte is gediagnosticeerd, gedeeld door het verwachte percentage mensen dat in leven is op basis van levensverwachting in de algemene bevolking met dezelfde leeftijd en geslacht.
Leeftijdsstandaardisatie is toegepast volgens ICSS-indeling (Corazziari, Quinn, & Capocaccia, 2004)
Corazziari, I., Quinn, M., & Capocaccia, R. (2004). Standard cancer patient population for age standardising survival ratios. Eur J Cancer, 40(15), 2307-2316. doi:10.1016/j.ejca.2004.07.002
Fritz, A., Percy, C., Jack, A., Shanmugaratnam, K., Sobin, L., Parkin, D. M., & Whelan, S. (2000). International Classification of Diseases for Oncology (Vol. 3rd). Geneva: World Health Organization.
International Union Against, C. (2017). TNM Classification of Malignant Tumours (Vol. 8th edn). New York: John Wiley & Sons Ltd.